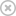przedruk:
Świat Nauki Luty 2008
W skrócie:
• Nieprawidłowo zbudowane i źle działające naczynia krwionośne są typową cechą guzów litych,
bezpośrednio związaną z ich złośliwością, a także upośledzającą dostarczenie leków do komórek
nowotworowych.
• Normalizacja naczyń krwionośnych w guzie ułatwia jego penetrację przez chemioterapeutyki i zwiększa ich skuteczność.
• Niespodziewanie okazało się, że leki, które zaprojektowano do niszczenia naczyń krwionośnych
w guzie, w pierwszej fazie działania naprawiają je, co daje nowe możliwości leczenia
nowotworów, a także pozwala odtworzyć normalne unaczynienie w przypadku innych chorób.
Uporządkowanie naczyniowego chaosu wewnątrz guzów nowotworowych daje nowe możliwości ich zwalczania. Niespodziewaną pomocą okazały się
w tym leki zaprojektowane do niszczenia naczyń. Mogą się one przydać także w terapii chorób układu krążenia i siatkówki
Rakesh K. Jain
O Autorze

Rakesh K. Jain jest profesorem biologii nowotworów i dyrektorem Laboratorium Biologii Nowotworów Edwina L. Steele'a w dziale radiologii onkologicznej Massachusetts General Hospital i Harvard Medical School. W badaniach nad naczyniami krwionośnymi i limfatycznymi oraz ich środowiskiem tkankowym
integruje biologię, obrazowanie, inżynierię i matematykę. Zajmuje się też klinicznym zastosowaniem
doświadczalnych odkryć nauk podstawowych. Jest wdzięczny National Cancer Institute za stałe wsparcie swych prac od 1980 roku i dziękuje ponad 200 doktorantom, naukowcom na stażach podoktorskich
i współpracownikom z całego świata, którzy towarzyszyli mu w niezwykłej podróży do wnętrza guzów litych.
Jain doradza także kilku firmom farmaceutycznym i biotechnologicznym. Jest członkiem National
Academy of Engineering i Institute of Medicine.
Będąc jeszcze doktorantem, miałem w 1974 roku okazję spojrzeć na złośliwe guzy zwykłej perspektywy. Pracowałem wówczas w National Cancer Institute w laboratorium nieżyjącego już Pietra M. Gullina, który stworzył nowatorski system do doświadczalnego badania biologii nowotworów: guz był połączony z układem krwionośnym szczura tylko jedna tętnicą i jedną żyłą. Jako inżynier chemik zdecydowałem się wykorzystać tę okazję, aby zmierzyć ile leku podanego zwierzęciu dopłynie do guza i ile z niego powróci. Okazało się, że większość wstrzykniętej substancji w ogóle nie zatrzymała się u celu. Co gorsza, ta niewielka ilość, której się udało, była rozmieszczona nierównomiernie – do niektórych miejsc prawie w ogóle nie dotarła.
Natychmiast zwróciłem uwagę na to, że komórki, które nie otrzymają dostatecznej dawki zaordynowanego leku przeciwnowotworowego, mogą przeżyć i nawet jeśli są nieliczne, wcześniej czy później guz odrośnie.
Inżynierską część mojej natury zafrapował problem krwionośnej infrastruktury nowotworu, ewidentnej przeszkody w podawaniu leków onkologicznych.
Przez następne dziesięciolecia wraz z moimi współpracownikami poszukiwałem przyczyn nieprawidłowej budowy naczyń krwionośnych guzów. Badaliśmy też, jak ten naczyniowy chaos utrudnia prowadzenie tradycyjnych terapii przeciwnowotworowych i bezpośrednio wiąż się z niektórymi złośliwymi cechami guzów litych. Na podstawie tych obserwacji opracowaliśmy sposoby normalizacji unaczynienia nowotworów i z powodzeniem przetestowaliśmy je na myszach. Podczas tych badań odkryliśmy swoisty paradoks - klasa leków zaprojektowanych do niszczenia naczyń krwionośnych w guzach w rzeczywistości najpierw je naprawia, a w tej fazie inne leki przeciwnowotworowe działają o wiele skuteczniej.
Dzięki postępowi badań w ostatnich latach mogliśmy już przetestować ten pomysł na pacjentach. Trudno opisać, z jaką radością przyjęliśmy pierwsze wyniki: zgodnie z naszymi przewidywaniami guzy zmniejszyły się w reakcji na normalizację ich naczyń. Potrzeba jeszcze wiele wysiłku, zanim dopracujemy tę terapię i ocenimy jej użyteczność. Ale to, czego już się nauczyliśmy o naprawie naczyń, umożliwia badania nad leczeniem innych zaburzeń naczyniowych, na przykład zwyrodnienia plamki żółtej, które jest jedną z głównych przyczyn ślepoty w starzejących się społeczeństwach krajów rozwiniętych.
Poplątane ścieżki
Podróż, która doprowadziła do naszych niedawnych sukcesów, zacząłem tak naprawdę kilka lat po ukończeniu studiów doktoranckich. Chcąc odkryć, dlaczego leki nie wnikają do guzów równomiernie, wraz z kolegami po stanowiliśmy najpierw prześledzić każdy z etapów tego procesu u gryzoni. Wykorzystując rozmaite techniki, obserwowaliśmy wędrówkę leków przez drobne naczyńka krwionośne guza, następnie przez ich ściany do otaczającej tkanki, potem do wnętrza komórek nowotworowych, a w końcu z powrotem, z guza do reszty ustroju. Razem z moimi studentami i współpracownikami rozwinęliśmy metody.
śledzenia cząsteczek, m.in. tlenu, we wnętrzu naczyń krwionośnych i tkanek. Nauczyliśmy się nawet podglądać włączanie się i wyłączanie genów w komórkach.
Od początku było jasne, że naczynia krwionośne w guzach niezbyt przypominają normalne. Zdrowe tkanki są odżywiane przez proste tętnice, te rozgałęziają się w przewidywalny sposób na coraz mniejsze, a w końcu na naczynia włosowate, tworząc docierającą wszędzie sieć, która dostarcza komórkom tlen i składniki odżywcze. Nowe naczynia krwionośne, których wzrost jest stymulowany przez guzy, układają się raczej w poplątany supeł. Łączą się ze sobą losowo, część gałęzi jest za duża, pojawiają się dodatkowe niedojrzałe naczynia włosowate, a w niektórych obszarach naczyń w ogóle nie ma.
Po wielu latach pracy zdołaliśmy opisać procesy rządzące przepływem płynów, leków i komórek w tym labiryncie i uzyskać wgląd w konsekwencje tych nieprawidłowości. Obraz, który się wyłonił, był ponury: od razu zrozumieliśmy, że naczynia krwionośne guza są nie tylko błędnie połączone i rozmieszczone, ale także nieprawidłowo zbudowane i źle funkcjonują. Odkryliśmy, że w niektórych prąd krwi jest dość wartki, w innych slaby, a w jeszcze innych okresowo zawraca. Taki rozkład przepływów utrudnia jednolite rozprowadzenie leku w guzie. Ponadto pewne odcinki ścian naczyń wręcz przeciekają, podczas gdy inne są wyjątkowo nieprzepuszczalne, przez co leki i inne cząsteczki, którym w ogóle udało się dostać do tego labiryntu, nierównomiernie przenikają do nieprawidłowej tkanki.
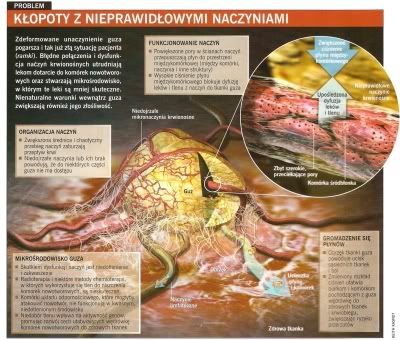
Kiedy zaczęliśmy badać przyczyny tej nierównomiernej przepuszczalności, odkryliśmy, że w części: guzów pory w ścianach naczyń maja aż jeden-dwa mikrometry średnicy, czyli są ponad sto razy większe niż normalnie.
W tak zbudowanych naczyniach niemożliwe jest utrzymanie właściwego gradientu ciśnień.
Prawidłowe ciśnienie płynu jest zwykle znacz nie wyższe w naczyniu niż w otaczających je tkankach Jednak gdy jego ściana jest bardzo porowata, płyn wycieka i zwiększa ciśnienie na zewnątrz naczynia, dopóki nie zrówna się ono z tym wewnątrz.
Tak nienaturalny gradient ciśnień to nie tylko przeszkoda w dotarciu leku do komórek. Gromadzący się płyn międzykomórkowy powoduje obrzęk wewnątrz i wokół guza. W przypadku guzów mózgu, ulokowanych w przestrzeni o rozmiarach ograniczonych przez czaszkę, obrzęk staje się sam w sobie poważnym problemem, często zagrażając życiu. W nowotworach innych typów płyn przesiękowy gromadzi się w jamach dała. Gdziekolwiek trafi, niesie ze sobą komórki rakowe, a także różne wyprodukowane przez guz białka, które stymulują wzrost nowych naczyń krwionośnych i limfatycznych w okolicznych tkankach i węzłach chłonnych.
Te naczynia mogą później posłużyć jako szlaki wędrówek komórek rakowych do innych części organizmu, czyli rozwoju przerzutów.
Jakby mało było problemów z nierównomierną dystrybucją leków i przeciekaniem płynu przez nieszczelne ściany, nieprawidłowe naczynia guza tworzą także wybitnie nienaturalne mikro środowisko w jego wnętrzu. Do wielu jego rejonów nie docierają, a nawet tam, gdzie docierają, często nie dostarczają odpowiedniej ilości tlenu. Wskutek tego we wnętrzu guza panuje zwykle stan niedotlenienia i wysoka kwasowość. Niedotlenienie komórki nowotworowe stają się bardziej agresywne i skłonne do tworzenia przerzutów. Co gorsza, komórki układu odpornościowego, które mogłyby pomóc w walce z guzem, w takich warunkach nie działają. To samo dotyczy radioterapii i części leków stosowanych w chemioterapii, których działanie opiera się na procesach chemicznych wykorzystujących tlen do niszczenia komórek
nowotworowych.
Badania prostych, zdawałoby się, nieprawidłowości w transporcie leków do guza doprowadziły zatem do odkrycia licznych mechanizmów upośledzenia terapii przez patologiczne naczynia krwionośne nowotworów.
Istnienia wielu z nich początkowo nawet nie podejrzewałem. Ten etap naszych prac podsumowałem w 1994 na łamach Scientific Amer.
can [patrz: Rakesh K. Jain „Bariery utrudniające wnikanie leków do guzów litych"; Świat Nauki, wrzesień 1994]. Już wtedy zebrane obserwacje skłoniły mnie i moich współpracowników do przypuszczeń, że gdybyśmy umieli naprawić strukturę i funkcjonowanie naczyń krwionośnych związanych z guzem, mielibyśmy szansę unormować jego mikro środowisko i tym sposobem poprawić skuteczność terapii przeciwnowotworowych. Aby to osiągnąć, trzeba było najpierw lepiej zrozumieć, dlaczego naczynia krwionośne w guzie stają się nieprawidłowe i co ten stan podtrzymuje.
Przywracanie równowagi
Zaczęliśmy się przyglądać cząsteczkom zaangażowanym w powstawanie normalnych naczyń krwionośnych, czyli angiogenezę, w tym tej najważniejszej - czynnikowi wzrostu śródbłonka naczyniowego (VEGF - vascular en-dothelial growth factor). VEGF został odkryty przez mojego kolegę z Harvard University, Harolda Dvoraka, i nazwany przez niego czynnikiem przepuszczalności naczyń. Pobudza on przeżycie i namnażanie się komórek śródbłonka, tworzących wewnętrzną warstwę naczyń krwionośnych, a w nadmiarze - zwiększa przepuszczalność naczyń (stąd jego pierwotna nazwa). Jednak w normalnych tkankach zbiorcze działanie tego białka i innych stymulujących wzrost cząsteczek jest równoważone przez naturalne związki antyangiogenne, w tym trombospondynę, które hamują wzrost naczyń.
Kiedy tkanki, czy to zdrowe, czy chore, potrzebują nowych naczyń krwionośnych, zwiększają produkcję cząsteczek stymulujących angiogenezę i zmniejszają produkcję jej inhibitorów, przesuwając w ten sposób równowagę w stronę tworzenia nowych naczyń.
W normalnych warunkach, na przykład podczas gojenia się ran, równowaga między czynnikami wzrostu a ich inhibitorami powraca, gdy nowe naczynia już powstaną. Ale w nowotworach i w wielu innych przewlekłych chorobach utrzymuje się nierównowaga, a naczynia stają się coraz bardziej nieprawidłowe.
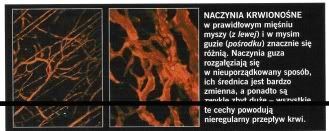
Ponieważ większość guzów litych zawiera dużo VEGF, podejrzewałem, że usunięcie jego nadmiaru lub zaburzenie sygnału, który wysyła, mogłoby przywrócić równowagę i spowodować, że naczynia guza choć częściowo wrócą do normalnego stanu. Inną drogą prowadzącą do normalizacji naczyń mogłoby być zwiększenie stężenia czynników hamujących angiogenezę. Przypuszczałem też, że w nowym stanie naczynia nie przetrwają długo - albo zostaną zniszczone przez silne inhibitory, albo powrócą do poprzedniej formy, jeśli guz nauczy się produkować inne czynniki wzrostowe, na przy kład zasadowy czynnik wzrostu fibroblastów (bFGF - basic fibroblast growth factor), który pod wieloma względami może naśladować VEGF. Jedynym sposobem, żeby to sprawdzić, było wypróbowanie działania inhibitorów angiogenezy na guzach.
W 1995 roku pracowano już nad terapeutycznymi przeciwciałami, które neutralizują działanie VEGF, więc mogliśmy je wykorzystać do przetestowania naszego pomysłu na myszach. Jedne przeciwciała łączą się bezpośrednio z VEGF, blokując wiązanie się go do receptorów na powierzchni komórki i przekazywanie sygnału do wzrostu komórkom śródbłonka. Inne zaś blokują receptory VEGF, uniemożliwiając przyłączenie się tego czynnika. Zastosowanie inhibitorów obu typów powodowało, że niektóre spośród niedojrzałych i źle działających naczyń, tak charakterystycznych dla guzów nowotworowych, rozpadały się, a inne ulegały przebudowie i przypominały normalne. Stawały się mniej przepuszczalne, węższe i mniej splątane. Stwierdziliśmy też poprawę ich funkcjonowania: spadek ciśnienia płynu międzykomórkowego, zwiększenie natlenienia tkanek i lepsze wnikanie leków.
Choć podekscytowały nas te wyniki oraz fakt, że innym naukowcom udało się powtórzyć nasze doświadczenia z podobnym skutkiem, nadal nie wiedzieliśmy, czy nasze metody zadziałają na ludzi tak samo jak na zwierzęta.
Wielu badaczy odnosiło się do naszych pomysłów ze zrozumiałym sceptycyzmem. Pod koniec lat dziewięćdziesiątych, kiedy po raz pierwszy publicznie przedstawiłem pomysł normalizacji naczyń krwionośnych w guzach, naukowcy z uniwersytetów i firm farmaceutycznych pracowali nad lekami niszczącymi naczynia. Wychodzili od hipotezy zaproponowanej w 1971 roku przez mojego kolegę z Harvardu, Judę Folkmana, według które guz można zagłodzić, traktując go lekami antyangiogennymi [patrz: Rakesh K. Jain i Peter Carmeliet „Naczynia życia i śmierci"; Świat Nauki, marzec 2002]. Rzeczywiście, lek o na zwie bewacyzumab (Avastin), zaaprobowany w 2004 roku przez amerykańską Agencję ds. Żywności i Leków (FDA) do stosowania w leczeniu nowotworów, to przeciwciało neutralizujące VEGF, opracowane z myślą o działaniu antyangiogennym.
Badania laboratoryjne i kliniczne wykazały, że bewacyzumab niszczy naczynia krwionośne w guzach u zwierząt i ludzi. Niemniej stosowany samodzielnie nie wydłuża życia chorych na raka. Jedynie w badaniu klinicznym, które rozstrzygnęło o jego zarejestrowaniu przez FDA, zwiększał całkowitą przeżywalność wśród pacjentów z zaawansowanym rakiem jelita grubego, ale tylko stosowany razem ze standardową chemioterapią. Ten wynik wydawał się wtedy paradoksalny. W zasadzie lek niszczący naczynia krwionośne powinien obniżać skuteczność chemioterapii, ponieważ dostarczenie chemioterapeutyków do komórek nowotworowych wymaga istnienia działających naczyń krwionośnych. Niektóre opublikowane wcześniej badania rzeczywiście pokazywały, że środki antyangiogenne mogą przeszkadzać w radio- i chemioterapii. Jak zatem pogodzić te wyniki?
Nasz zespół znalazł odpowiedź na to pytanie dzięki dokładnym badaniom struktury i funkcjonowania naczyń krwionośnych w guzach pacjentów z rakiem odbytnicy otrzymujących bewacyzumab oraz skojarzoną chemio- i radioterapię w ramach badań klinicznych przeprowadzonych w 2002 w National Cancer Institute przez Christophera Willetta, obecnie pracującego w Duke University Medical Center. Bardzo szybko zauważyliśmy, że zmiany w unaczynieniu guzów nie ograniczały się do prostego niszczenia naczyń. Dwa tygodnie po wstrzyknięciu bewacyzumabu przepływ krwi w guzach spadł o 30-50% u sześciu pacjentów. Gęstość naczyń włosowatych, całkowita liczba naczyń krwionośnych oraz ciśnienie płynu międzykomórkowego w guzach także się zmniejszyły. Ponadto komórki guza, które nie miały już dostępu do zniszczonych lekiem naczyń, częściej ginęły w procesie apoptozy, czyli programowanejśmierci komórki, charakterystycznej odpowiedzi na brak tlenu i składników odżywczych. Zaskoczyło nas jednak, że nie towarzyszyło temu zmniejszenie zużycia energii przez guz, zmierzone za pomocą oceny wychwytu znakowanej glukozy. A tego należało oczekiwać, gdyby nowotwór był tylko głodzony. Wyglądało na to, że ocalałe i „naprawione" naczynia w guzie wydajniej zaspokajały potrzeby energetyczne pozostałych komórek nowotworowych. Ponadto tempo proliferacji komórek rakowych w niektórych guzach wzrosło, odzwierciedlając ich dostęp do lepiej działających naczyń i normalizację mikrośrodowiska w tkance. Zwiększenie proliferacji z jednej strony grozi przyśpieszeniem wzrostu guza i nie jest zjawiskiem pożądanym, ale z drugiej strony komórki mnożące się powinny być bardziej wrażliwe na standardowe chemioterapeutyki, które zazwyczaj działają właśnie na tym etapie cyklu komórkowego.
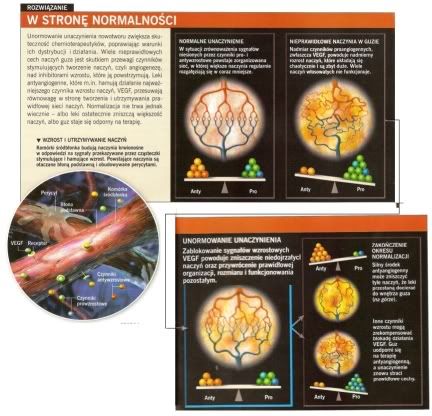
Wyniki te łącznie dały wgląd w rzeczywisty mechanizm działania bewacyzumabu i podobnych leków, wyjaśniając, dlaczego przez jakiś czas mogą poprawiać skuteczność radio- i chemioterapii. Ponieważ bewacyzumab blokuje działanie VEGĘ część naczyń w guzie jest niszczona od razu, a pozostałe „normalnieją". Skutkiem tego jest poprawa mikrośrodowiska guza oraz zwiększenie podatności komórek nowotworowych na pewne leki, które są teraz skuteczniej do nich dostarczane.
Okres względnie prawidłowego funkcjonowania naczyń nowotworowych to hipotetycznie czas największej efektywności różnych terapii przeciwnowotworowych.
Okienko możliwości
Aby w praktyce wykorzystać nowe informacje o współdziałaniu terapii antyangiogennej z radio- czy chemioterapią, onkolog musi wiedzieć, kiedy naczynia krwionośne w guzie pacjenta zaczynają wracać do normy i jak długo utrzyma się ten stan. Wróciliśmy więc do eksperymentów na myszach, żeby lepiej scharakteryzować ten czas, który nazwaliśmy „okresem normalizacji". Wykorzystaliśmy zwierzęcy model guzów mózgu i badaliśmy efekt podania przeciwciała zaprojektowanego tak, by blokowało główny receptor VEGF w komórkach śródbłonka. Już po jednym dniu zauważalne były oznaki rozpoczynającej się normalizacji naczyń krwionośnych. Podczas okresu normalizacji - który trwa tylko od pięciu do sześciu dni - natlenienie guza wzrastało, a radioterapia dawała najlepsze wyniki. Później także inne grupy w doświadczeniach na zwierzętach potwierdziły nasze obserwacje. Zebranych dowodów było tyle, że dostaliśmy zgodę na przeprowadzenie w National Cancer Institute kolejnego badania klinicznego na ludziach. Zakończona zaledwie roktemu próba, prowadzona przez Trący Batchelor i Gregory'ego Sorensena, moich kolegów z Massachusetts General Hospital, objęła 30 osób, u których guzy mózgu, zwane glejakami, odrastały mimo agresywnego leczenia chirurgicznego, radio- i chemioterapii. Pacjenci z tak zaawansowaną chorobą zwykle nie przeżywają sześciu miesięcy.
W ramach próby chorzy codziennie otrzymywali doustną dawkę cediranibu (AZD2171, Recentin), eksperymentalnego leku, który silnie hamuje trzy główne receptory VEGĘ Zaawansowane techniki obrazowania umożliwiły nam śledzenie działania leku na guzy. Efekty zobaczyliśmy niemal od razu Oznaki normalizacji, w tym zmniejszenie średnicy i przepuszczalności naczyń, trzymywały się co najmniej 28 dni, a niektóre - nawet przez cały czas trwania ba dania, czyli cztery miesiące. Ponadto, zgodnie z przewidywaniami wynikającymi z naszego modelu, normalizacji naczyń towarzyszyło zmniejszenie obrzęku guza i jego sąsiedztwa, widoczne przez cały okres podawania leku.
Ponieważ blokada receptorów VEGF daje silne działania niepożądane, niektórzy prosili o przerwę w terapii. Dzięki temu mogliśmy za obserwować, że po odstawieniu leku naczynia guza znów stają się nieprawidłowe, a po jego powtórnym podaniu powracają do normy. Dzięki tej pracy po raz pierwszy udało się określić, jak długo u ludzi trwa okres normalizacji naczyń, i doprowadzić do trwającej obecnie znacznie większej próby klinicznej, która obejmuje 300 osób i ma na celu dokładniejsze zbadanie roli cediranibu, stosowanego w połączeniu z chemioterapią lub samodzielnie, w leczeniu glejaka. Badamy też efektywność innych związków antyangiogennych w zestawieniu z tradycyjnymi terapiami w leczeniu nowo zdiagnozowanych lub nawracających nowotworów innych typów. Równocześnie szukam) sposobów na rozciągnięcie okresu normalizacji, co pozwoliłoby wydłużyć przeżycie z miesięcy do lat. W każdej proponowanej strategii naprawy naczyń trzeba brać pod uwagę, że samo zablokowanie VEGF nie zawsze wystarcza do osiągnięcia lub utrzymania normalizacji, ponieważ nowotwory mogą zacząć produkować inne czynniki wzrostu, żeby zastąpić brak sygnałów wysyłanych przez VEGĘ Na przykład rosnące guzy oprócz VEGF wytwarzają wiele dodatkowych czynników proangiogennych, więc ich naczynia mogą stopniowo przestać reagować na terapie bewacyzumabem i podobnymi lekami.
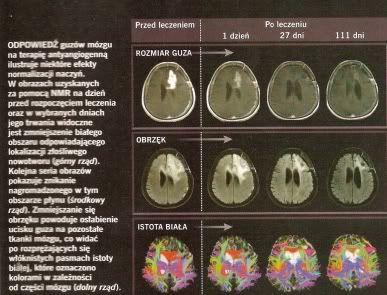
U pacjentów chorych na raka odbytnicy odkryliśmy na przykład, że po podaniu bewacyzumabu we krwi wzrastał poziom VEGF i podobnej cząsteczki PIGF (placental growth factor -lozyskowego czynnika wzrostu), co sugeruje, ze guz lub inne tkanki zaczynają produkować wiej tych czynników. A u pacjentów z nawracającym glejakiem stężenie wielu innych cząsteczek o działaniu proangiogennym rosło kiedy guzy przestawały reagować na terapie cediranibem. To zróżnicowanie sygnałów prowzrostowych ilustruje jakim wyzwaniem będzie dla onkologow indywidualne dobranie każdemu pacjentowi i mieszanki leków pasujących do profilu molekularnego guzów pierwotnych i przerzutowych, który w dodatku może się z czasem zmieniać. Warto jednak zauważyć, że dostępne narzędzia stymulujące normalizację naczyń nie ograniczają się do leków działających bezpośrednio na VEGF i inne czynniki wzrostu. Na przykład ostatnio dowiedliśmy na myszach, że trastuzumab (Herceptin) - przeciwciało przeciw białku HER2 występującemu na powierzchni komórek guza, zalecane co czwartej kobiecie z rakiem piersi – może wyzwalać odpowiedź podobną do tej wywoływanej przez mieszankę czynników antyangiogennych. czyli normalizować naczynia guza. Herceptyna pośrednio obniża produkcję kilku proangiogennych cząsteczek przez komórki, zwiększając równocześnie produkcję antyangiogennej trombospondyny-1.
Oprócz identyfikacji starych i opracowania nowych leków działających normalizująco na naczynia ważne jest znalezienie najmniej inwazyjnych i najtańszych sposobów monitorowania procesu normalizacji, aby jak najefektywniej wykorzystać go podczas terapii.
Wraz z moimi współpracownikami poszukujemy więc tzw. biomarkerów - łatwych do zmierzenia oznak tego, co dzieje się we wnę trzu guza, które pomogą określić, kiedy się zaczyna i jak długo trwa okres normalizacyjnemu poszczególnych pacjentów. Takimi markerami mogą być na przykład białka we krwi lub w moczu, których poziom w tym czasie wzrasta lub spada.
Odkrycie, że leki antyangiogenne mogą normalizować naczynia, nie podważa sensowności wykorzystania ich w celu, w jakim zostały stworzone. Jeśli lek jest na tyle mocny i specyficzny, żeby zniszczyć wystarczająco dużo naczyń w guzie i w konsekwencji go zagłodzić, ratując tym sposobem życie chorego, wszyscy będą zadowoleni. Ale dzięki możliwości wykorzystania tych środków także do naprawy naczyń zyskaliśmy broń, którą możemy atakować nowotwór z więcej niż jednej strony. Na dłuższą metę te badania mogą też pomóc wielu milionom ludzi na świecie, którzy cierpią na inne choroby związane z nieprawidłowym unaczynieniem, na przykład zwyrodnienie plamki żółtej czy miażdżycę
Ponad 30 lat temu, kiedy wkraczałem na ścieżkę badania poplątanych i dysfunkcyjnych naczyń krwionośnych w guzach, nie wyobraża łem sobie, dokąd mnie zaprowadzi. Nie przypuszczałem też, że nadejdzie dzień, w którym pacjent z chorobą naczyń będzie mógł pójść do lekarza, zmierzyć poziom biomarkerów i otrzymać indywidualnie dobrany zestaw leków normalizujących te naczynia. Dziś sądzę, że dzień ten jest już blisko
Naprawa naczyń: nie tylko w raku
Setki milionów ludzi na całym świecie cierpią na nie nowotworowe choroby związane z nieprawidłowościami unaczynienia tkanek. Modulacja wzrostu i funkcjonowania naczyń krwionośnych może się okazać kluczowym elementem ich terapii. Tak działające leki mogą więc wywrzeć olbrzymi wpływ na zdrowie społeczeństwa.
Najpowszechniejszym problemem z tej kategorii jest miażdżyca - choroba tętnic polegająca na gromadzeniu się złogów tłuszczów w postaci blaszek w wewnętrznych warstwach ścian naczyń krwionośnych. Wewnątrz takich złogów zbierają się prozapalne komórki krwi i najrozmaitsze śmieci, stopniowo zwiększając ich rozmiary. Z czasem w tej masie pojawiają się odżywiające ją nowe naczynia, które – podobnie jak w przypadku nowotworów - często są zbyt przepuszczalne i poplątane. Teoretycznie zastosowanie leków antyangiogennych powinno znormalizować naczynia we wnętrzu płytek, czyli zatrzymać powiększanie się złogów i zmniejszyć szanse na ichpęknięcie.
Choroby oczu, na przykład retinopatię cukrzycową czy wysiękową postać zwyrodnienia plamki żółtej (AMD - age-related macular degeneration), także cechuje nieprawidłowe unaczynienie podobne do tego w guzach litych. Znakiem rozpoznawczym wysiękowego zwyrodnienia plamki żółtej jest właśnie nadmierna przepuszczalność naczyń krwionośnych w siatkówce. W rezultacie osocze krwi przesącza się do sąsiednich tkanek, powodując całkowitą lub częściową utratę wzroku. Tylko w USA na tę chorobę cierpi ponad 9 min osób. Nic więc dziwnego, że jeśli pominąć nowotwory, leki antyangiogenne przyniosły największy postęp w leczeniu właśnie
wysiękowej postaci AMD. Do terapii tej choroby dopuszczono już dwa inhibitory VEGF, ranibizumab (Lucentis) i pegaptinib (Macugen), które działają, prawdopodobnie normalizując zbytnią przepuszczalność naczyń.
Ta sama zasada może się okazać użyteczna w kontrolowaniu chorób powodujących gromadzenie się płynów w tkankach (obrzęki), a także w inżynierii tkankowej i medycynie regeneracyjnej, które wymagają stworzenia i utrzymania normalnie funkcjonującej sieci naczyń.
» JEŚLI CHCESZ WIEDZIEĆ WIĘCEJ
Antiangiogenic Therapy for Norma-lization of Atherosclerotic Plaque Vasculature: A Potential Strategy for Plaque Stabilization. Rakesh K.
Jain i in.;
Nature Clinical Practice Cardiovascular Medicine, tom 4, nr 9, s. 491-503; IX/2007.
Angiogenesis in Brain Tumors. Ra-kesh K. Jain i in.; Nature Reviews Neuroscience, tom 8, s. 610-622; VIII/2007.
Lessons from Phase III Trials of Anti-VEGF Therapy for Cancer. Rakesh K. Jain, Dan G. Duda. Jeffrey W. Clark i Jay S. Loeffler; Nature Clinical Practice Oncology, tom 3, nr l,s. 24-40; 1/2006.
Normalization of the Tumor Vasculature: An Emerging Concept in Anti-Angiogenic Therapy of Cancer. Rakesh K. Jain; Science, tom 307, s. 58-62; 1/2005.
Więcej artykułów Rakesha K. Jaina i animacje przedstawiające normalizację naczyń można znaleźć na stronie: http://steele.mgh.harvard.edu/